
Штаммы Plasmodium falciparum приобрели устойчивость к хлорохину благодаря мутации в транспортном белке PfCRT
Малярийный плазмодий в эритроцитах человека. Фото с сайта www.iayork.com
Хлорохин был впервые синтезирован в 1934 году. Благодаря своей высокой эффективности и дешевизне он вскоре стал главным оружием медиков в борьбе с малярией, оттеснив хинин и другие препараты на второй план. Но уже через четверть века, в конце 1950-х годов, почти одновременно в двух точках земного шара — в Колумбии и Таиланде — появились штаммы возбудителя малярии Plasmodium falciparum, устойчивые к хлорохину. В течение последующих 20 лет они распространились из этих двух эпицентров практически по всем территориям, где встречается малярия.
Генетики установили, что причиной устойчивости являются мутации в одном из генов паразита. Белок, кодируемый этим геном, получил название PfCRT (Plasmodium falciparum Chloroquine Resistance Transporter). Этот белок локализуется в мембране, окружающей пищеварительную вакуоль паразита — пузырек, в котором происходит переваривание гемоглобина. По аминокислотной последовательности белка PfCRT было ясно, что это мембранный белок, выполняющий транспортную функцию, — но какие именно вещества он перекачивает через мембрану, до сих пор не было известно.
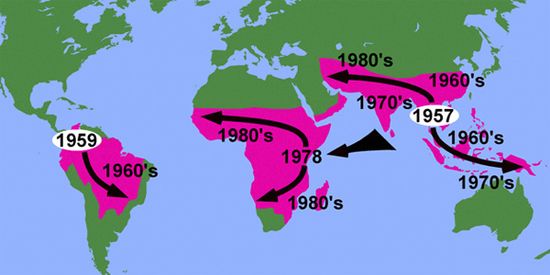
Схема распространения штаммов малярийного плазмодия Plasmodium falciparum, устойчивых к хлорохину. Рис. с сайта static.rnw.nl
У «нормальных», восприимчивых к хлорохину плазмодиев хлорохин проникает в пищеварительную вакуоль путем простой диффузии. Внутри вакуоли pH значительно ниже, чем снаружи. Попав в кислую среду, молекула хлорохина присоединяет к себе дополнительный протон и приобретает положительный заряд. Это лишает ее возможности выйти обратно из вакуоли — молекула оказывается в ловушке. В результате хлорохин накапливается в вакуоли, мешая паразиту переваривать гемоглобин.
У паразитов, устойчивых к хлорохину, лекарство в пищеварительной вакуоли не накапливается. Поскольку устойчивость связана с мутациями в транспортном белке, можно было предположить, что благодаря этим мутациям белок PfCRT приобрел способность откачивать хлорохин из вакуоли. Чтобы проверить это предположение, австралийские ученые ввели ген плазмодия, кодирующий белок PfCRT, в яйцеклетки лягушки и заставили его там работать. Кроме того, они добились, чтобы образующийся белок оказывался не на мембранах вакуолей или каких-то других внутриклеточных структур, а на наружной клеточной мембране (чтобы легче было исследовать функцию белка). Для этого пришлось применить целый ряд хитростей.
Главная сложность состояла в том, что в норме белок PfCRT располагается на мембране вакуоли, а это значит, что в его аминокислотной последовательности, скорее всего, имеются какие-то сигнальные участки, которые указывают клетке, что данный белок нужно доставить именно к мембране вакуоли. Обычно такие сигнальные фрагменты располагаются на одном из двух концов белковой молекулы. Введение в яйцеклетку лягушки исходного, необработанного варианта гена не приводило к появлению белка PfCRT на наружной мембране. По всей видимости, белок в клетке синтезировался, но не попадал на поверхность, а направлялся к каким-то внутриклеточным мембранам. Только после того, как авторы удалили несколько «подозрительных» участков на обоих концах гена (то есть участков, сходных с какими-либо из известных сигнальных последовательностей, управляющих локализацией белков в клетке), им удалось получить лягушачьи яйцеклетки с белком PfCRT, вмонтированным в наружную клеточную мембрану. Таким образом удалось сконструировать удобную систему для изучения свойств белка PfCRT.
Выяснилось, что «мутантный» вариант белка, заимствованный у устойчивого к хлорохину штамма малярийного плазмодия, действительно способен весьма эффективно перекачивать хлорохин через мембрану (в данном случае — из внешней среды в цитоплазму яйцеклетки), если значение pH в окружающей среде примерно такое же, как в пищеварительной вакуоли плазмодия. Тот же белок, взятый у чувствительного к хлорохину плазмодия, этой способностью не обладает.
Таким образом, устойчивость паразитов к хлорохину объясняется тем, что белок PfCRT в результате мутаций приобрел новую функцию. Исходный вариант этого белка, по всей видимости, отвечал за транспорт каких-то других веществ из пищеварительной вакуоли в цитоплазму. Каких именно — это так и осталось неизвестным.
Ранее было показано, что существует не один, а несколько мутантных вариантов белка PfCRT, обеспечивающих устойчивость к хлорохину (авторы обсуждаемой работы экспериментировали с одним из них). У всех этих вариантов имеется только одна общая особенность — замена лизина треонином в позиции 76. Аминокислота, стоящая в этой позиции, входит в состав активного центра, который отвечает за распознавание и связывание транспортируемой молекулы. Лизин, в отличие от треонина, имеет положительный заряд. По-видимому, это мешает положительно заряженному хлорохину присоединиться к белку-транспортеру.
Авторы установили, что если в мутантном белке произвести обратную замену (вместо треонина поставить лизин), белок теряет способность перекачивать хлорохин через мембрану. С другой стороны, если в «нормальном», не обеспечивающем устойчивости к хлорохину белке заменить лизин треонином, он не приобретает этой способности. Таким образом, данная аминокислотная замена является необходимым, но не достаточным условием приобретения новой функции. Чтобы белок начал выкачивать из вакуоли хлорохин, в нем должны произойти еще какие-то мутации. В какой последовательности паразиты приобретали комплекс мутаций, отвечающих за устойчивость к хлорохину, выяснить пока не удалось.
Изготовленная авторами лабораторная модель — лягушачьи яйцеклетки с белком PfCRT в наружной мембране — может иметь и практическое значение, поскольку она очень удобна для испытания лекарств. Авторам уже удалось выяснить механизм действия некоторых препаратов (в частности, верапамила), которые применяются в комплексе с хлорохином для борьбы с устойчивыми штаммами плазмодия. Как и следовало ожидать, эти препараты подавляют активность мутантного белка PfCRT и не дают ему транспортировать хлорохин через мембрану.
Источник:
1. Rowena E. Martin, Rosa V. Marchetti, Anna I. Cowan, Susan M. Howitt, Stefan Bröer, Kiaran Kirk. Chloroquine Transport via the Malaria Parasite’s Chloroquine Resistance Transporter // Science. 2009. V. 325. P. 1680–1682.
2. Цитируется с http://elementy.ru/news/431147
- ← предыдущая
- Вакцинация против вируса гриппа A(H1N1) начнется 9 ноября 2009 года
- Нобелевская премия 2009 по химии
- следующая →